


suivant: La zone non saturée
monter: L'eau dans la zone
précédent: L'eau capillaire
Table des matières
Les particules solides constitutives d'une formation poreuse, qui ont
une teneur importante en particules colloidales (dimension: 10-3 -
10-6 mm) ont la capacité de fixer ou d'échanger des ions à leur
surface par adsorption. La plupart des minéraux argileux ont une
dimension colloidale.
Les minéraux argileux, souvent à charges négatives, s'entourent
facilement d'un cortège de molécules d'eau H2O. L'eau est
adsorbée fortement du fait de son caractère dipolaire, par exemple
par la Montmorillonite ou 1a Kaolinite.
Cette adsorption induit un gonflement des argiles, surtout de 1a
Montmorillonite à grande surface interne (lg - 800m2), beaucoup
moins de la Kaolinite. Quand aux smectites, elles deviennent
plastiques dans des conditions humides.
C'est bien sûr ce gonflement et le très fort lien entre eau et
minéraux qui donne le caractère imperméable aux argiles.
En fonction de la force relative de leur fixation, les ions liés aux
argiles peuvent être échangés contre d'autres.
En principe les ions bivalents sont plus fortement liés aux argiles
et ainsi retenus par les argiles que les ions monovalents. D'après
Freeze, l'affinité d'adsorption par les alcalino-terreux et les
alcalins est la suivante:
| Plutôt |
Ba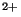 |
 |
Sr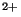 |
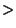 |
Ca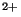 |
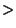 |
Mg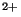 |
Plutôt |
| fort |
Rb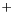 |
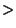 |
K+ > Na+ > Li+ faible |
|
|
|
|
|
Ces échanges sont fonction de - l'hydratation des ions
- la concentration des ions
- la nature des ions
- la nature du minéral argileux
Par exemple:
1) Les résines en Na+ captent le Ca 2+; on les régénère en réimprégnant la résine avec une liqueur très concentrée en Na+.
2) Sur les nappes d'eau en écoulement, on étudie beaucoup les rapports Mg/Ca et Na/C1 et leur variabilité spatiale.
Les minéraux argileux se séparent quelquefois de la roche qui les contient et se regroupent sous forme d'agrégats (particules collées par des phénomènes physiques ou électriques). Ces agrégats de faible dimension deviennent des colloides mobiles (minéraux ou organiques) qui circulent dans l'eau entourés d'un cortège de molécules H2O et quelquefois d'autres éléments chimiques (par ex. des radionucléides).
Si l'on veut parfaire le caractère imperméable des argiles, on les traite au chlorure de calcium (augmentation de la structure dispersée qui favorise l'imperméabilité). En fait, les ions Ca++ pénètrent dans les argiles et les "disloquent".



suivant: La zone non saturée
monter: L'eau dans la zone
précédent: L'eau capillaire
Table des matières
2002-08-27